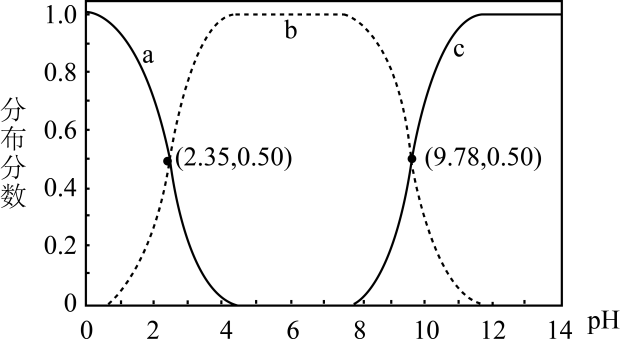
1.
室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),、和三种粒子的物质的量之和等于0.1mol。
【考点】
离子浓度大小的比较;