1.
我国科研团队将工业废气中的 在催化条件下还原,实现了
在催化条件下还原,实现了 的绿色合成。主要反应有:
的绿色合成。主要反应有:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)
对反应Ⅰ:
(2)
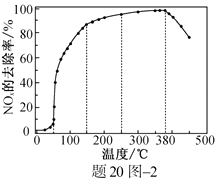
在恒压密闭容器中,分别按投料比 为
为 和
和 通入气体,若只发生反应Ⅰ和Ⅱ,
通入气体,若只发生反应Ⅰ和Ⅱ, 的平衡转化率
的平衡转化率 及
及 的选择性S随温度的变化曲线如图所示。
(3)
甲醇有多种用途,甲醇碱性(KOH)燃料电池中负极的电极反应式为。
的选择性S随温度的变化曲线如图所示。
(3)
甲醇有多种用途,甲醇碱性(KOH)燃料电池中负极的电极反应式为。
①。
②已知: , 图1中表示
与T之间的关系正确的是(填字母)。

③相对能量及其部分反应历程关系如图2(Al~A4,B1~B4表示过渡态)。反应更容易按路径(填A或B)发生,该路径中形成过渡态(填编号)的反应速率最慢。

④下列说法正确的是。
A.平衡时,
B.催化剂降低了反应的活化能,可以增大平衡转化率
C.恒温密闭的刚性容器中,的分压不变时体系达到平衡状态
D.反应过程中催化剂可能会“中毒”,需对反应气进行净化处理

已知:
①投料比为时,
的平衡转化率曲线为(填“e”或“f”)。
②温度升高,选择性降低、
的平衡转化率升高的原因是。
③投料比为、温度为320℃时,反应Ⅱ的平衡常数
(写出计算式即可,用物质的量分数代替平衡浓度)。
【考点】
盖斯定律及其应用;
电极反应和电池反应方程式;
能力提升
真题演练