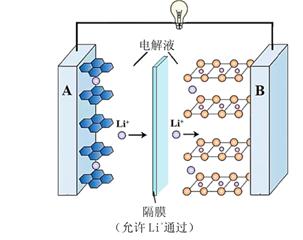
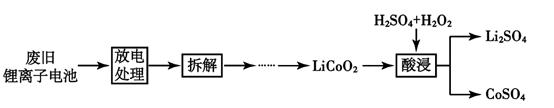
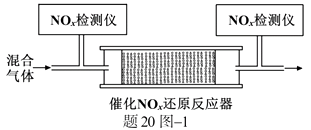
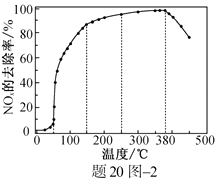
1.
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)
氮元素原子的L层电子数为;
(2)
NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;
(3)
肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气.
(4)
肼一空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为.
已知:①N2(g)+2O2(g)=N2O4 (1)△H1=﹣19.5kJ•mol﹣1
②N2O4(1)+O2(g)=N2(g)+2H2O△H2=﹣534.2kJ•mol﹣1写出肼和N2O4反应的热化学方程式;
【考点】
盖斯定律及其应用;
电极反应和电池反应方程式;
能力提升
真题演练