1.
电池在我们的生活中有着重要的应用,请回答下列问题:
(1)
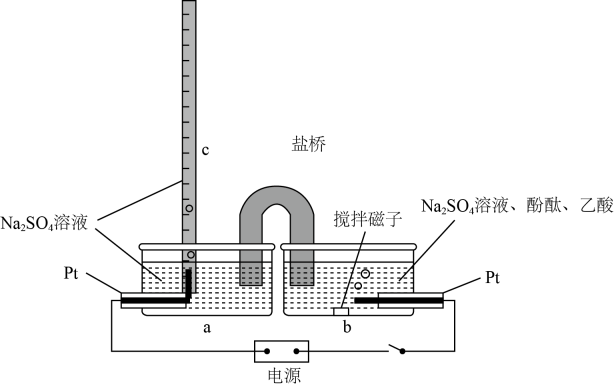
为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是(填序号)。若构建原电池时两个电极的质量相等,当导线中通过0.1mol电子时,两个电极的质量差为。
(2)
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
(3)
利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移向(填“电极a”或“电极b”),负极发生的电极反应式为。
(4)
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是。


实验测得OH-向B电极定向移动,则(填“A”或“B”)处电极入口通甲烷,其电极反应式为。当消耗甲烷的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为。


【考点】
原电池工作原理及应用;
能力提升
真题演练