1.
某课题组研究CO2加氢制甲醇。涉及的主要反应有:
反应I:
反应Ⅱ:
反应Ⅲ:
反应Ⅳ:CO(g) +2H2(g)CH3OH(g) ΔH4
回答下列有关问题:
(1)
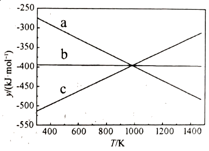
反应Ⅳ的ΔH4 = kJ·mol-1。
(2)
下列有关说法正确的有___________。(填字母)
A.
增大压强,CO的物质的量分数一定增大
B.
当甲醇的浓度不再改变时,体系达到平衡
C.
在恒容密闭容器中充入Ar,反应Ⅲ速率不变
D.
升温时,反应Ⅱ逆反应速率加快的程度大于正反应速率
(3)
在一定条件下,向容器中充入1 mol CO2和3 mol H2 , 同时发生上述四个反应。平衡时,CO2的转化率、含碳产物的选择性(转化的CO2中生成CH3OH、CH4或CO的百分比,如甲醇的选择性 )与温度关系如图所示,回答下列问题。
(4)
一种在铜基催化剂上CO2加氢制甲醇的机理如图所示,其中吸附在铜基催化剂表面上的物种用“*”标注。
)与温度关系如图所示,回答下列问题。
(4)
一种在铜基催化剂上CO2加氢制甲醇的机理如图所示,其中吸附在铜基催化剂表面上的物种用“*”标注。

①随着温度升高,甲醇选择性降低而CO2的转化率却升高的原因可能是。
②在T温度下,若CH4的选择性为10%,则此时CO的物质的量为mol。H2的转化率为%。

①该化学反应的反应历程分步进行。
②对总反应速率影响较大的关键步骤(决速步)的基元反应方程式为。
【考点】
盖斯定律及其应用;
化学反应速率的影响因素;
化学平衡的计算;
能力提升
真题演练