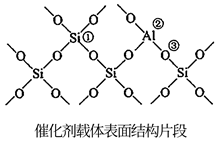
1.
丙酮蒸气热裂解可生产乙烯酮,反应为 (g)⇌O=C=CH2(g)+CH4(g)
(g)⇌O=C=CH2(g)+CH4(g)  , 现对该热裂解反应进行研究,回答下列问题:
, 现对该热裂解反应进行研究,回答下列问题:
化学键 | C−H | C−C | C=C |
键能 | 412 | 348 | 612 |
(1)
根据表格中的键能数据,计算
 ;
(2)
丙酮的平衡转化率随温度、压强变化如图所示:
(3)
在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)经过时间tmin,丙酮转化了10%。
(4)
其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。工业上选择催化剂(填“甲”或“乙”)。
;
(2)
丙酮的平衡转化率随温度、压强变化如图所示:
(3)
在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压(110kPa)经过时间tmin,丙酮转化了10%。
(4)
其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。工业上选择催化剂(填“甲”或“乙”)。

①图中X表示的物理量是;
②A、C两点化学平衡常数KAKC(填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是。
①用单位时间内气体分压变化表示的反应速率v(丙酮)=kPa/min;
②该条件平衡时丙酮转化率为a,则KP=(以平衡时分压代替浓度计算)(分压![]() 总压×物质的量分数)
总压×物质的量分数)

【考点】
反应热和焓变;
化学平衡常数;
能力提升
真题演练







 (g) ∆H1<0
(g) ∆H1<0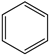 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4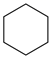 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5