1.
活性氧化锌是重要的工业添加剂。某工厂利用硫酸与氧化铜锌矿(主要成分是 , 还含有少量SiO2和Fe2O3等杂质)为原料制取活性氧化锌,流程如下:
, 还含有少量SiO2和Fe2O3等杂质)为原料制取活性氧化锌,流程如下:

【查阅资料】①过氧化氢在60℃时的分解率为时分解率达90%。
② ③H2O2具有氧化性,可把Fe2+氧化成Fe3+。
(1)
为提高“酸浸”的速率,可采取的措施有(写一条)。“酸浸”过程中涉及的化学方程式(写一个)。
(2)
“除铜”时,加入过量铁粉的目的。
(3)
“氧化”时,反应温度不能过高的原因是。
(4)
“操作I”的名称是。
【考点】
金属的化学性质;
酸的化学性质;
能力提升
真题演练



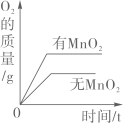 两份完全相同的双氧水在有无MnO2情况下产生O2
两份完全相同的双氧水在有无MnO2情况下产生O2 在密闭容器中用红磷测定空气中氧气的含量
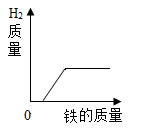
在密闭容器中用红磷测定空气中氧气的含量 向等质量等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉
向等质量等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉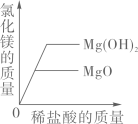 向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸至过量
向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸至过量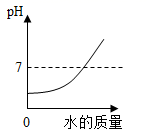
 表示加热一定质量的氯酸钾和二氧化锰固体混合物
表示加热一定质量的氯酸钾和二氧化锰固体混合物 表示分别向等质量的锌粉和铝粉中滴加稀硫酸至过量
表示分别向等质量的锌粉和铝粉中滴加稀硫酸至过量 表示向NaOH溶液中逐滴加入稀盐酸
表示向NaOH溶液中逐滴加入稀盐酸 表示铁和AgNO3溶液反应
表示铁和AgNO3溶液反应