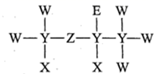1.
下列事实不能用元素周期律解释的是
A.
酸性:HClO4>H2SO3
B.
碱性: C.
气态氢化物的稳定性:HF>HBr
D.
C.
气态氢化物的稳定性:HF>HBr
D.
 从
从 溶液中置换出
溶液中置换出
【考点】
元素周期表中原子结构与元素性质的递变规律;
基础巩固
能力提升
变式训练
拓展培优
真题演练