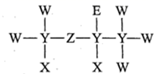1.
X3Y4Z2W2R 结构如图所示,X、Y、Z、W、R 原子序数依次增大,R 为周期表中电负性最大的元素。下列说法错误的是

A.
简单气态氢化物热稳定性:W<R
B.
最高价氧化物对应水化物的酸性:Y<Z
C.
X3Y4Z2W2R 中采用 sp2 杂化的原子只有 1 种
D.
首次在实验室合成 YW(ZX2)2 , 打破了有机化合物与无机物的界限
【考点】
元素周期表中原子结构与元素性质的递变规律;
基础巩固
能力提升
变式训练
拓展培优
真题演练