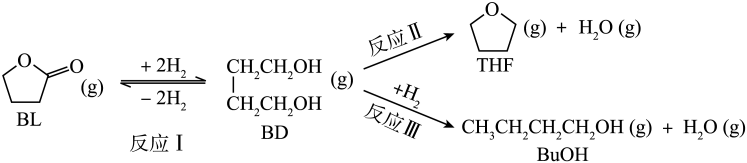
1.
将 转化为
转化为 、
、 等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
(1)
 时,
时, 还原
还原 的热化学方程式如下:
(2)
若反应I的正反应活化能表示为
的热化学方程式如下:
(2)
若反应I的正反应活化能表示为 , 则
, 则 41(填“
41(填“ ”“
”“ ”或“
”或“ ”)。
(3)
”)。
(3)
 , 向
, 向 密闭容器中充入
密闭容器中充入
 和
和
 , 发生反应I,
, 发生反应I, 达到平衡时,测得
达到平衡时,测得 的物质的量为
的物质的量为 。
(4)
在
。
(4)
在 , 压强为
, 压强为 时,
时, 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
I:
II:
已知反应I、II的平衡常数分别为、
。由盖斯定律可知,
与
反应生成
的热化学方程式为,
(用
、
表示)。
①平衡时的体积分数
②下列措施既能加快反应速率又能提高的平衡转化率的是。
A.升高反应温度 B.增大的浓度
C.分离出 D.缩小容器容积
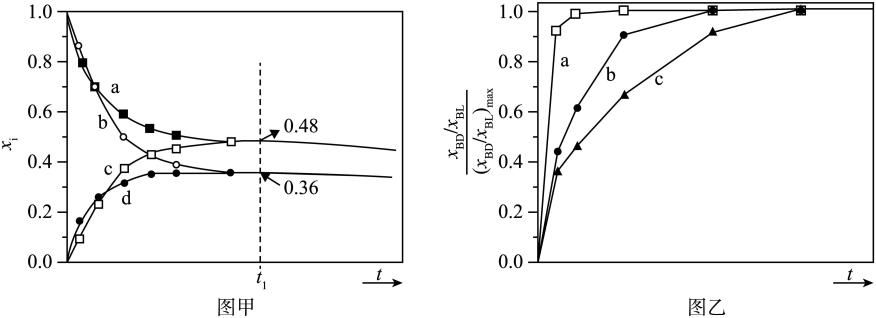
③ , 向
密闭容器中充入
和一定量的
, 发生反应I,两种气体的平衡转化率(a),与起始反应物的物质的量之比
的关系如图所示:

能表示平衡转化率曲线的是(填
或
),M点的纵坐标:
。
【考点】
化学平衡的影响因素;
化学平衡的计算;
能力提升
真题演练