1.
小科在学习金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气。他想镁紧排在钠后面,它是否也能与水反应呢?他进行了如下探究。
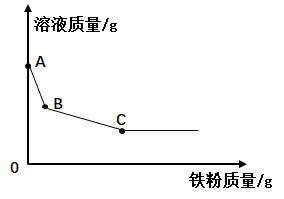
在两个烧杯中,分别加入等量的冷水和镁条,分别如图甲和图乙进行操作。实验过程和现象如图:

(1)
小科得出的实验结论是。
(2)
一段时间后,小科观察到镁条在热水中无现象,但当他想到实验室制取二氧化碳不能用稀硫酸和大理石反应时,便有了解释。他的解释是。
(3)
小科发现B试管放置空气中一会儿溶液的红色会褪色,这说明溶液的碱性减弱了。于是他大胆作出了一个猜想并设计了验证方案:
猜想 | 验证方案 |
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性的减弱。 | 实验器材: 实验方案: |
小科通过实验验证了自己的猜想是正确的。
【考点】
金属活动性顺序及其应用;
能力提升
真题演练