1.
催化剂的研究是一项重要的课题,某小组以“探究催化剂的奥秘”为题展开了项目式学习。
(1)
【任务一】认识催化剂
催化剂在化工生产中起着重要作用,其在化学反应前后都不变
(2)
【任务二】探究催化剂
(3)
步骤对比可以证明氧化铜能够加快过氧化氢的分解速率。
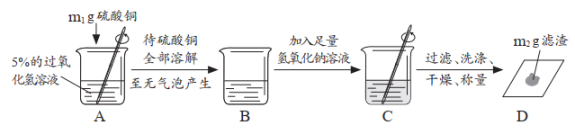
(4)
步骤②中反应的文字表达式为
(5)
步骤⑦的目的是
(6)
【任务三】探究不同催化剂的催化效果
催化剂在化工生产中起着重要作用,其在化学反应前后都不变

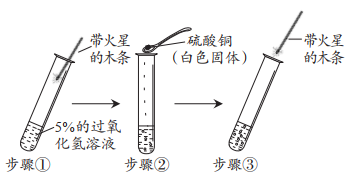
小组同学查阅资料发现氧化铜(Cu0)也可作为过氧化氢分解的催化剂,于是设计了如图实验进行验证,请填写下表:
步骤①现象 | 步骤③现象 | 步骤⑥结果 | 实验结论 |
无明显现象 | 试管中有气泡产生,带火星的木条 | 氧化铜的质量为 | 氧化铜是过氧化氢分解的催化剂 |
小组同学以生成 100 m氧气为标准,设计了下列实验。
序号 | 5% H0,溶液的体积 | 催化剂 | 待测数据 |
① | 200 mL | 2g 氧化铜 | a |
② | 200 mL | 2g 二氧化锰 | b |
表中的待测数据是若 a>b,可得到的结论是的催化效果较好
【考点】
催化剂的特点与催化作用;
影响化学反应速率的因素探究;
能力提升
真题演练