1.
学习了“过氧化氢制氧气使用二氧化锰作催化剂”,化学社团在“寻找新的催化剂”的活动中,对“硫酸铜能否作过氧化氢分解的催化剂”进行了以下探究。
(1)
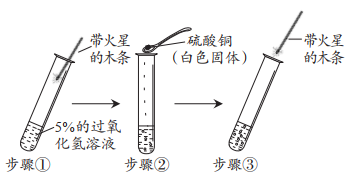
【实验探究】甲同学按如下方案进行实验。
(2)
【评价改进】大家认为甲同学的实验结论不严谨。若要确定该实验结论正确,还需证明硫酸铜的在反应前后都没有发生改变。
(3)
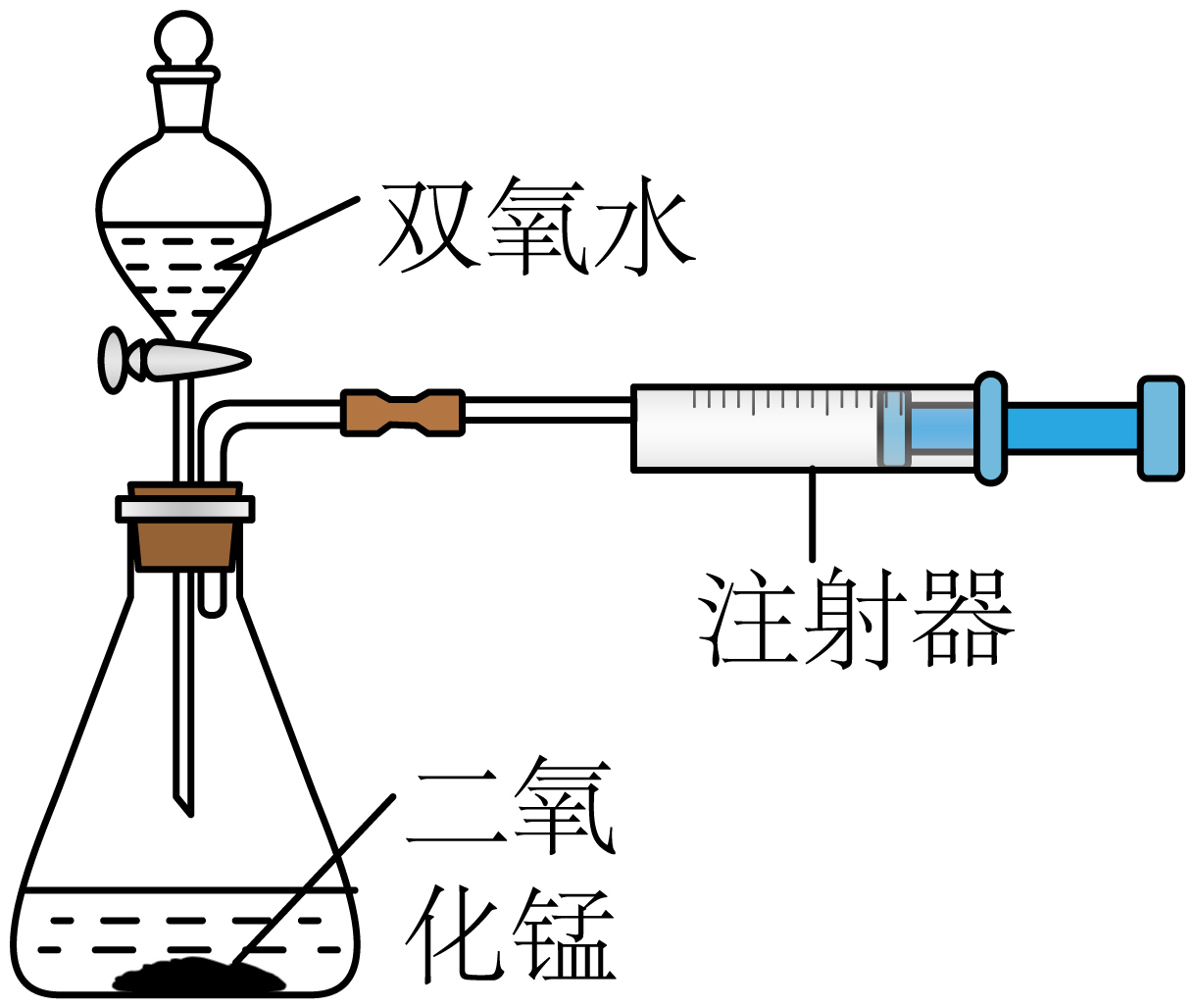
【继续探究】乙同学补做以下实验,进而确认了甲同学的实验结论。
(4)
【讨论交流】大家认为还可以采取另一种方法获取上述实验结论:在甲同学实验的基础上,将乙同学实验时烧杯B中的溶液蒸发、干燥得到白色固体,再称其质量为g,然后将固体加入5%的过氧化氢溶液中,仍然可以加速过氧化氢分解。
(5)
【拓展延伸】比较硫酸铜和二氧化锰对过氧化氢制氧气的催化效果,实验过程中不需要控制的条件是____(填序号)。
A.
溶液的起始温度
B.
催化剂的质量
C.
溶液的浓度
D.
反应起始时间
实验步骤 | 实验现象 | 实验结论 |
| 步骤①木条不复燃; 步骤②产生气泡,溶液变蓝色; 步骤③。 | 硫酸铜能作过氧化氢分解的催化剂,反应的化学方程式为。 |
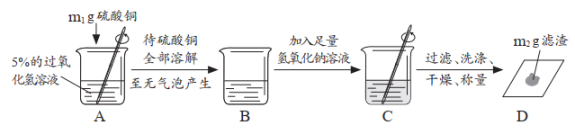
根据上述实验中m1:m2=,证明反应前后铜离子没有发生变化;将实验方案中的氢氧化钠溶液换成溶液,再次实验,证明反应前后硫酸根离子也没有发生变化。
【考点】
催化剂的特点与催化作用;
影响化学反应速率的因素探究;
能力提升
真题演练