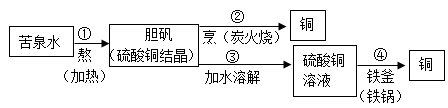
1.
Mg(OH)2具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂,过滤,得到只含MgSO4和H2SO4的混合溶液。为确定混合溶液中硫酸镁的含量,现取混合溶液100g,再逐渐加入一定质量分数的NaOH溶液30g,产生Mg(OH)2沉淀质量如图所示。

(1)
实验开始时,并未立即生成Mg(OH)2沉淀的原因是
(2)
充分反应后,最终溶液中的溶质是。
(3)
计算100g混合溶液中含MgSO4的质量(需写出计算过程)。
【考点】
复分解反应及其应用;
能力提升
真题演练