1.
以乙炔为原料合成聚苯乙烯{ }的路线如图。请根据所学知识回答下列问题:
}的路线如图。请根据所学知识回答下列问题:
 }的路线如图。请根据所学知识回答下列问题:
}的路线如图。请根据所学知识回答下列问题:
(1)
乙炔为(填“极性”或“非极性”)分子。
(2)
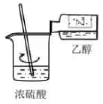
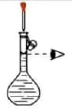
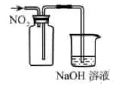
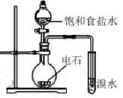
实验室制备乙炔并检验其性质的装置如图。
(3)
写出合成路线中反应③的化学方程式:。
(4)
合成路线中,符合原子经济性的反应为(填标号)。

①盛有饱和食盐水的仪器名称为;该实验开始前应先进行的操作为。
②B装置中的现象为。
③C装置中的现象为,发生的反应类型为反应。
④D装置中发生反应的化学方程式为(反应中、
, 反应中乙炔表现出的性质为。
【考点】
乙炔炔烃;
能力提升
真题演练