1.
乙炔是重要的化工原料。我校化学研究性学习小组同学进行了如下探究。
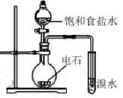
I.甲组同学利用电石中的CaC2与H2O反应制C2H2 , 并通过排水测量出反应产生的气体的体积,从而测定电石中CaC2的含量。
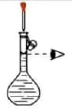
(1)实验装置如图所示,仪器b的名称为;该反应制取C2H2气体的原理是;(用化学方程式表示)

(2)研究性学习小组进行实验时,有下列操作(每项操作只进行一次):
①仪器a中注入饱和食盐水,c中注入适量水。
②称取一定量电石,置于仪器b中,塞紧橡皮塞
③检查装置的气密性。
④待仪器b恢复到室温时,量取仪器d中水的体积(导管中水忽略不计)。
⑤慢慢开启仪器a的活塞,使饱和食盐水逐滴滴下至不产生气体为止,关闭活塞。
正确的操作顺序是。(填写操作编号)
(3)若实验时称取电石的质量为 , 测量出排水的体积后,折算成标准状况下C2H2的体积为
, 测量出排水的体积后,折算成标准状况下C2H2的体积为 , 则此电石中CaC2的质量分数为。(假设其它物质不反应)
, 则此电石中CaC2的质量分数为。(假设其它物质不反应)
Ⅱ.为探究乙炔与溴的加成反应,乙组同学设计并进行了如下实验:
①先取一定量的工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
②丙组同学发现在乙组同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能有少量含硫的还原性杂质气体(有臭鸡蛋气味)。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(4)乙组同学设计的实验(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是。
A.使溴水褪色的物质,就是乙炔
B.使溴水褪色的物质,未必是乙炔
C.使溴水褪色的反应,就是加成反应
D.使溴水褪色的反应,未必是加成反应
(5)丙组同学推测此乙炔中必定含有的一种杂质气体,该气体与溴水反应的化学方程式是,在验证过程中必须全部除去。
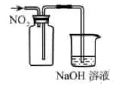
(6)请你选用下列四个装置(见下图,可重复使用)来实现丙组同学的实验方案,将装置的编号填入方框,并写出装置内所放的化学药品。

(7)为验证这一反应是加成而不是取代,丙同学提出可用 试纸来测试反应后溶液的酸性。理由是。
试纸来测试反应后溶液的酸性。理由是。
【考点】
乙炔炔烃;
能力提升
变式训练
拓展培优
真题演练



 }的路线如图。请根据所学知识回答下列问题:
}的路线如图。请根据所学知识回答下列问题:



 ,
,


 的路线如下。
的路线如下。