1.
下列装置和药品的选择正确的是
A | B | C | D |
|
|
|
|
实验室制氨气 | 除去CO2中混有的少量HCl | 验证SO2的漂白性 | 收集NO2气体 |
A.
A
B.
B
C.
C
D.
D
【考点】
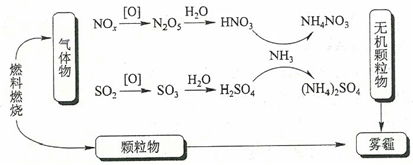
氮的氧化物的性质及其对环境的影响;
基础巩固
能力提升
拓展培优
真题演练