1.
把煤作为燃料可通过下列两种途径:
途径Ⅰ:①
途径Ⅱ:先制成水煤气:②
再燃烧水煤气:③
④
(1)
则途径Ⅰ放出的热量①(填“大于”“等于”或“小于”)途径Ⅱ放出的热量; 与
与 、
、 、
、 的数学关系式是②。
(2)
水蒸气与足量红热的炭即产生水煤气:
的数学关系式是②。
(2)
水蒸气与足量红热的炭即产生水煤气: ,
,  (3)
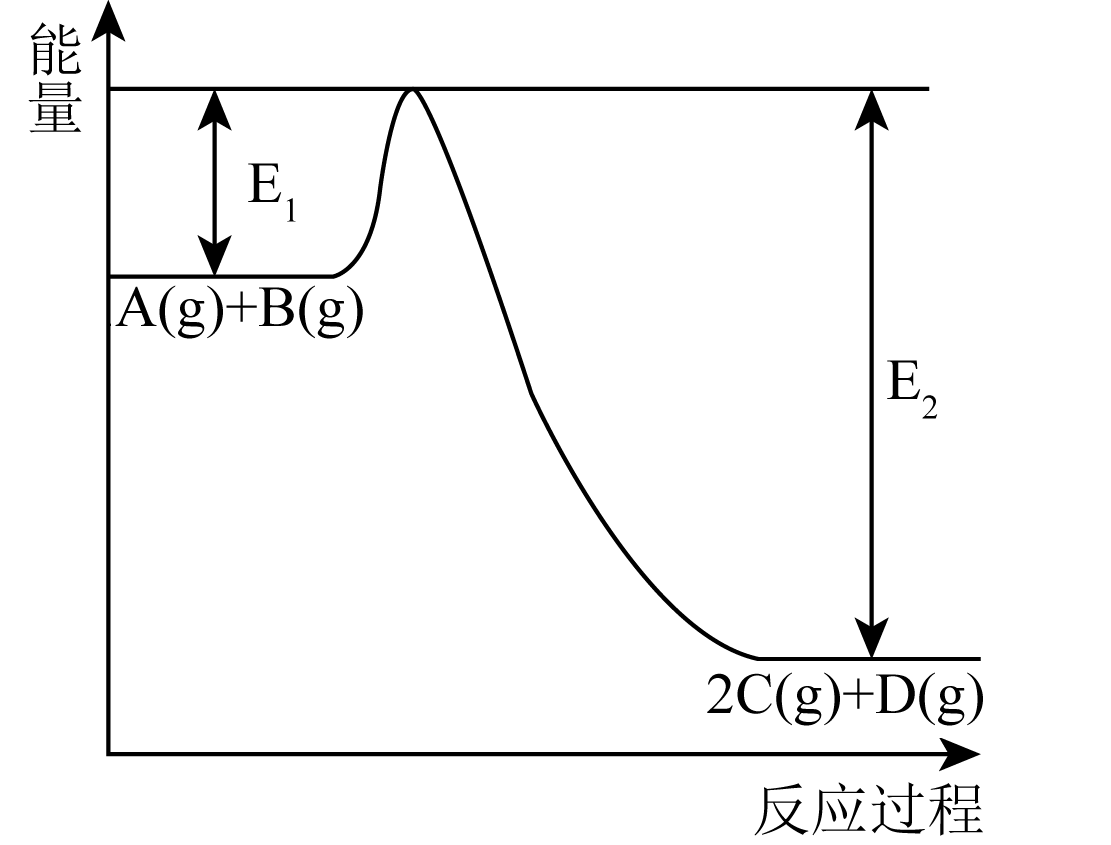
一定条件下,
(3)
一定条件下, 和
和 发生反应时,生成
发生反应时,生成 、
、 或HCHO的能量变化如下图所示[反应物
或HCHO的能量变化如下图所示[反应物 和生成物
和生成物 略去]。
略去]。
①该反应在(填“高温”或“低温”)下能自发进行。
②写出该反应的平衡常数表达式。
③温度升高平衡常数(填“增大”“减小”或“不变”),恒温恒容条件下,再投入 , 平衡向方向移动,达到新平衡时与原平衡状态相比
(填“增大”“减小”或“不变”)

在有催化剂作用下,与
反应主要产物为①;无催化剂时,升高温度更有利于提高的产率。
【考点】
焓变和熵变;
化学平衡常数;
化学平衡的影响因素;
能力提升