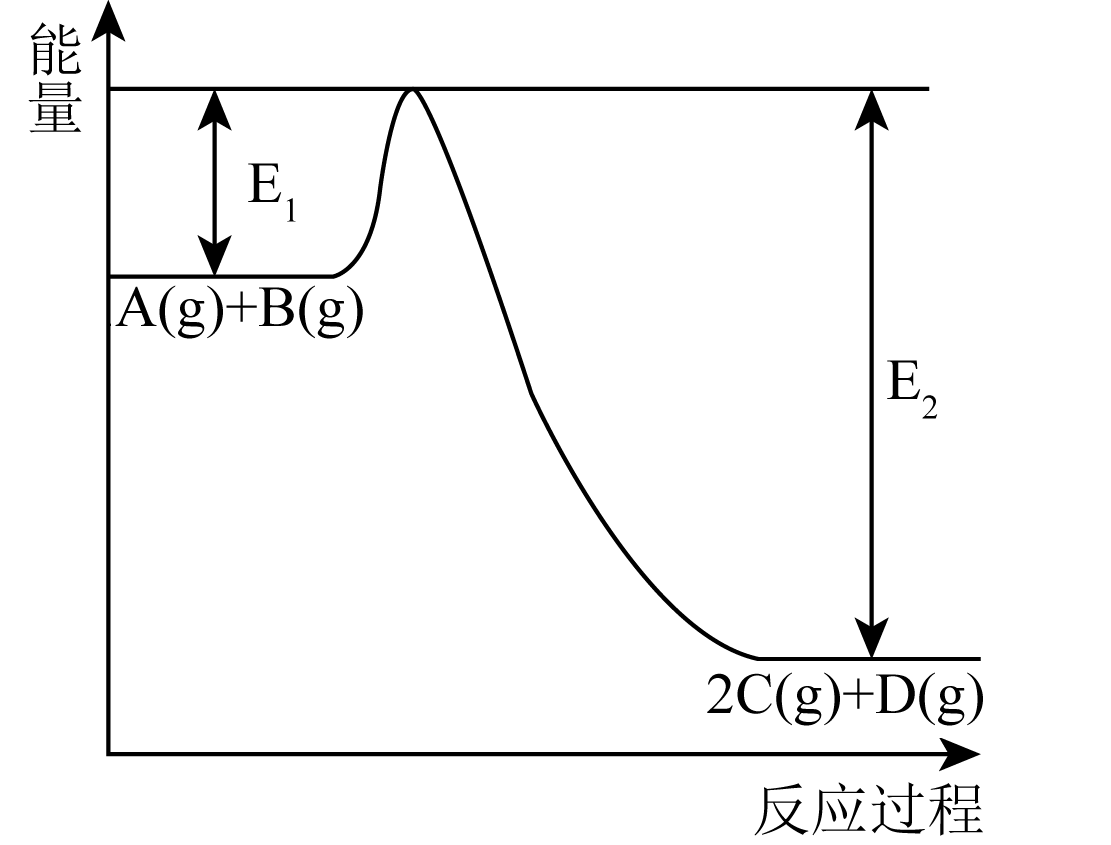
1.
我国力争于2030年前做到“碳达峰”,2060年前实现“碳中和”。 捕获与
捕获与 重整是
重整是 利用的研究热点。其中
利用的研究热点。其中 与
与 重整反应体系涉及部分反应如下:
重整反应体系涉及部分反应如下:
a.
b.
c.
(1)
已知 , 则反应c在(填“高温”“低温”“任意温度”或“不能”)自发进行。
(2)
上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
A.
增大
, 则反应c在(填“高温”“低温”“任意温度”或“不能”)自发进行。
(2)
上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
A.
增大 与
与 的浓度,反应a、b、c的正反应速率都增大
B.
移去部分
的浓度,反应a、b、c的正反应速率都增大
B.
移去部分 , 反应c,b的平衡向右移动,反应a向左移动
C.
加入反应a的催化剂,可提高
, 反应c,b的平衡向右移动,反应a向左移动
C.
加入反应a的催化剂,可提高 的平衡转化率
D.
降低反应温度,反应a、b、c的正、逆反应速率都减小
(3)
雨水中含有来自大气的
的平衡转化率
D.
降低反应温度,反应a、b、c的正、逆反应速率都减小
(3)
雨水中含有来自大气的 , 溶于水中的
, 溶于水中的 会进一步和水反应,发生电离:
(4)
105℃时,将足量的某碳酸氢盐(
会进一步和水反应,发生电离:
(4)
105℃时,将足量的某碳酸氢盐( )固体置于真空恒容容器中,存在如下平衡:
)固体置于真空恒容容器中,存在如下平衡: 。上述反应达平衡时体系的总压为46kPa.保持温度不变,开始时在体系中先通入一定量的
。上述反应达平衡时体系的总压为46kPa.保持温度不变,开始时在体系中先通入一定量的 , 再加入足量
, 再加入足量 , 欲使平衡时体系中水蒸气的分压小于5kPa,
, 欲使平衡时体系中水蒸气的分压小于5kPa, 的初始压强应大于kPa。(已知:体系中某气体的分压=该气体的体积分数×总压)
(5)
的初始压强应大于kPa。(已知:体系中某气体的分压=该气体的体积分数×总压)
(5)
 可以被NaOH溶液捕获。若所得溶液
可以被NaOH溶液捕获。若所得溶液 , 溶液
, 溶液 。(室温下,
。(室温下, 的
的 ;
; )
(6)
CaO可在较高温度下捕集
)
(6)
CaO可在较高温度下捕集 , 在更高温度下将捕集的
, 在更高温度下将捕集的 释放利用,请从化学反应原理角度分析其原因是。与
释放利用,请从化学反应原理角度分析其原因是。与 热分解制备的CaO相比,
热分解制备的CaO相比, 热分解制备的CaO具有更好的
热分解制备的CaO具有更好的 捕集性能,其原因是。
捕集性能,其原因是。
①
②
25℃时,反应②的平衡常数为。溶液中
的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为
, 当大气压强为
, 大气中
的物质的量分数为x时,溶液中
浓度为
(写出表达式,忽略水和
的电离)。
【考点】
焓变和熵变;
化学平衡常数;
化学平衡的影响因素;
能力提升