1.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大。A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。
(1)
A的基态原子中,电子占据的最高能层符号为,该能层的原子轨道数为。
(2)
比较B与C原子的电负性,并从原子结构的角度说明原因。
(3)
A与C形成的非极性分子的电子式为。 离子的价层电子的轨道表示式是。
(4)
D元素的最高价氧化物对应的水化物中,中心原子的杂化轨道类型是,B元素气态氢化物的价层电子对的空间结构为。
(5)
离子的价层电子的轨道表示式是。
(4)
D元素的最高价氧化物对应的水化物中,中心原子的杂化轨道类型是,B元素气态氢化物的价层电子对的空间结构为。
(5)
 的空间结构为,
的空间结构为, 的水溶液可以用于实验室中
的水溶液可以用于实验室中 离子的定性检验,若形成六配位的配合物,该反应的离子方程式为。
(6)
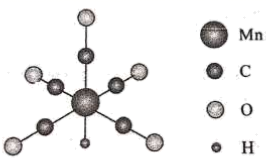
某化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为。该晶胞上下底面为正方形,侧面与底面垂直,该晶体的密度为
离子的定性检验,若形成六配位的配合物,该反应的离子方程式为。
(6)
某化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为。该晶胞上下底面为正方形,侧面与底面垂直,该晶体的密度为 , 则阿伏加德罗常数
, 则阿伏加德罗常数
 (用含a、b、
(用含a、b、 的式子表示)。(
的式子表示)。( )
)

【考点】
元素电离能、电负性的含义及应用;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练