1.
现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量的变化。回答下列问题:
(1)
下列反应中,属于放热反应的是(填标号)。
(2)
某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置:
(3)
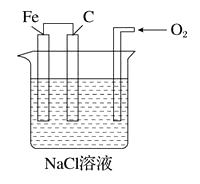
电能是现代社会应用最广泛的能源之一,化学电源应用于现代社会的生产和生活。
(4)
反应速率方程可表示反应物浓度与反应速率的定量关系。NO与H2反应的速率方程为 (k、m、n待测,其中k为常数,一般只受温度影响,指数m、n可以通过实验进行测定)。已知在T℃时,不同浓度NO与H2对应的反应速率如下表所示。
(k、m、n待测,其中k为常数,一般只受温度影响,指数m、n可以通过实验进行测定)。已知在T℃时,不同浓度NO与H2对应的反应速率如下表所示。
A.盐酸与碳酸氢钠反应
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
C.Zn和稀硫酸反应
D.KOH溶液和稀硝酸反应
E.灼热的炭与二氧化碳反应

能探究“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是(填装置序号)。

①某氢氧燃料电池装置如图所示,a、b均为惰性电极。电池工作时,空气从(填“A”或“B”)通入,正极的电极反应式为。
②若把氢氧燃料电池中的氢气换为肼(N2H4),N2H4被氧化为氮气,负极发生的电极反应式为。
序号 | 速率/ | ||
I | 6.00×10-3 | 2.00×10-3 | 2.16×10-3 |
Ⅱ | 1.20×10-3 | 2.00×10-3 | 8.64×10-3 |
Ⅲ | 6.00×10-3 | 4.00×10-3 | 4.32×10-3 |
可以推测,速率方程中的m=,n=。
【考点】
吸热反应和放热反应;
电极反应和电池反应方程式;
化学反应速率和化学计量数的关系;
能力提升