1.
电化学还原 将其转化为其它化学产品,是一种综合利用
将其转化为其它化学产品,是一种综合利用 的好方法。
的好方法。

已知:选择性(S)和法拉第效率(FE)的定义:
×100%;
×100%
(1)
碱性电化学还原 前,先在中性电解液中通电一段时间,
前,先在中性电解液中通电一段时间, 及电流稳定后,再通
及电流稳定后,再通 。在阴极区若
。在阴极区若 每得到
每得到 电子,同时有
电子,同时有 也会得到等物质的量的电子,且阴极区电解液的
也会得到等物质的量的电子,且阴极区电解液的 几乎保持不变(忽略溶液体积变化)。
(2)
控制
几乎保持不变(忽略溶液体积变化)。
(2)
控制 、电解液中存在
、电解液中存在 时,电化学还原
时,电化学还原 过程中
过程中 (其他含碳产物未标出)和
(其他含碳产物未标出)和 的法拉第效率变化如图3所示。
的法拉第效率变化如图3所示。
①补全阴极产生的电极反应
![]() ___________+
___________+![]() ___________
___________![]() ___________。
___________。
②阴极附近发生反应(用离子方程式表示),生成的难以放电,降低了
。结合上述信息,
的理论最大值为。
③结合化学用语分析阳极区产生的原因是。

①结合图3的变化规律,推测可能的作用是。
②时,
(已折合为标准状况,下同)的
被完全吸收并还原为
和
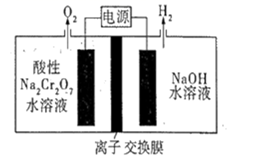
, 分离
后,将
和
混合气体通入如图4所示装置(反应完全),出口处收集到气体
。则
为。
【考点】
电解池工作原理及应用;
能力提升
真题演练