1.
我国力争2030年前实现“碳达峰”,2060年前实现“碳中和”。其中的关键技术是运用催化转化法实现二氧化碳的综合利用。 催化加氢制乙醇是促进碳中和实现的重要途径,其中涉及的反应如下:
催化加氢制乙醇是促进碳中和实现的重要途径,其中涉及的反应如下:
反应I:
反应II:
反应III:
回答下列问题:
(1)
 催化加氢制乙醇反应的
催化加氢制乙醇反应的 kJ/mol;该反应能在(填“高温”或“低温”或“任何温度”)自发进行。
(2)
在2L恒容密闭容器中分别投入2mol
kJ/mol;该反应能在(填“高温”或“低温”或“任何温度”)自发进行。
(2)
在2L恒容密闭容器中分别投入2mol 和6mol
和6mol , 进行反应I。
(3)
在总压为pMPa的条件下,按
, 进行反应I。
(3)
在总压为pMPa的条件下,按 和
和 投料比为1∶1、1∶2、1∶3向密闭容器中投入
投料比为1∶1、1∶2、1∶3向密闭容器中投入 和
和 进行反应I,
进行反应I, 的平衡转化率与温度、投料比
的平衡转化率与温度、投料比 的关系如图所示:
的关系如图所示: (4)
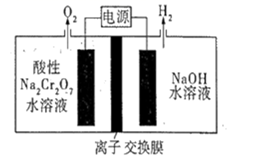
利用电解的方法,也可以实现
(4)
利用电解的方法,也可以实现 到乙醇的转变,则碱性电解质溶液中,阴极反应式为;标准状况下,2.24L
到乙醇的转变,则碱性电解质溶液中,阴极反应式为;标准状况下,2.24L 参与反应时,转移的电子数为(设
参与反应时,转移的电子数为(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
①下列描述能说明该反应达到平衡状态的是(填标号)。
A.容器内混合气体的密度保持不变
B.容器内压强保持不变
C.容器内混合气体的平均摩尔质量不再改变
D.和
的物质的量之比保持不变
E.
②容器中乙醇的物质的量与时间的关系如图所示,若容器a中改变条件时,反应情况会由曲线a变为曲线b,则改变的条件是;容器a中0~10min内,用氢气表示的平均反应速率。


①从平衡角度分析,随温度升高,不同投料比时的平衡转化率趋于相近的原因是。
②A点时,该反应的平衡常数(列出代数式即可;压力平衡常数
是以气体分压来表示反应的平衡常数)。
【考点】
电解池工作原理及应用;
能力提升
真题演练