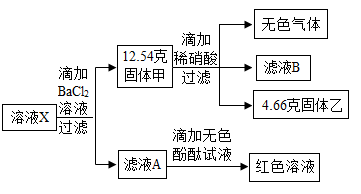
1.
实验室中有一种含有纯碱(Na2CO3)、小苏打(NaHCO3)和少量水的固体粉末样品。为了测定其中小苏打的含量,某科学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验。

已知:
①该装置气密性良好,A、C、D中所装药品足量且能完全吸收相关物质;
②碱石灰是CaO与NaOH的固体混合物;
③加热条件下,纯碱稳定不分解,小苏打易分解,反应的化学方程式为:
探究过程如下:
Ⅰ.称量样品和已装入相关药品的装置C、D的质量,分别为:m、m1、m2;
Ⅱ.将质量为m的样品装入B玻璃管中,按图连接好装置,关闭弹簧夹,给玻璃管加热;
Ⅲ.待玻璃管中样品完全反应,打开弹簧夹通空气,再熄灭酒精灯,直到玻璃管冷;
Ⅳ.再次称量装置C、D的质量,分别为m3、m4。
请回答下列问题:
(1)
装置C中所装药品为。
(2)
依据实验所得数据计算,该样品中小苏打的质量分数为(用相关字母表示)。
(3)
误差分析。按上述实验步骤测得该样品中小苏打的质量分数偏大,理由是。
【考点】
根据化学反应方程式的计算;
物质的鉴别、推断;
能力提升
真题演练