1.
下列化学用语表示正确的是
A.
乙酸的分子式:CH3COOH
B.
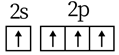
羟基的电子式: C.
乙烯的结构简式:CH2CH2
D.
丙烷的空间充填模型:
C.
乙烯的结构简式:CH2CH2
D.
丙烷的空间充填模型:

【考点】
用电子式表示简单的离子化合物和共价化合物的形成;