1.
可用下列装置完成对应实验的是
|
|
|
|
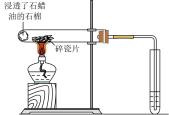
制备并收集乙酸乙酯 | 证明乙醇与浓硫酸共热生成乙烯 |
|
|
|
|
验证葡萄糖与银氨溶液可发生银镜反应 | 分离 |
A.
A
B.
B
C.
C
D.
D
【考点】
性质实验方案的设计;
基础巩固
能力提升
拓展培优
真题演练