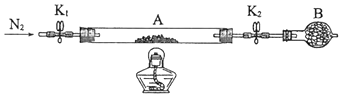
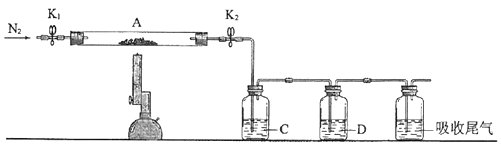
1.
工业上常用绿矾(FeSO4•7H2O)作还原剂。
(1)
检验久置绿矾是否变质可用试剂。
(2)
①工业上常用FeCl3溶液刻蚀铜电路板,反应的离子方程式为。
(3)
如何检验滤液A中含有Fe2+?。
腐蚀废液含FeCl2、FeCl3、CuCl2 , 某小组欲从腐蚀废液中回收铜及制绿矾,工艺流程如图:

②操作I中使用的玻璃仪器除烧杯、玻璃棒外还有;腐蚀废液中加入过量铁粉的目的。
③固体A中含有。
④反应I中生成FeCO3沉淀同时有CO2和水生成,反应的离子方程式为:。
【考点】
铁盐和亚铁盐的相互转变;
二价铁离子和三价铁离子的检验;
能力提升
真题演练