1.
工业合成氨是人类科学技术的一项重大突破。回答下列问题:
(1)
合成氨工业中采用循环操作,主要是为了(填选项字母)。
A.
增大化学反应速率
B.
提高氮气和氢气的利用率
C.
降低氨的沸点
D.
提高平衡混合物中氨的含量
(2)
在密闭容器中通入amolN2和6molH2 , 若在一定条件下反应达到平衡状态,容器中剩余cmolN2。
(3)
研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的微粒用*标注。
①达到平衡时,H2转化率为。
②若把容器的体积扩大一倍,则正反应速率(填“增大”、“减小”或“不变”,下同),逆反应速率,H2的转化率。

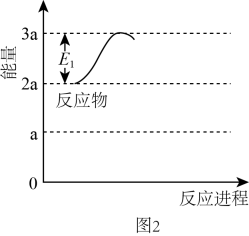
该反应历程中最大活化能对应步骤的化学方程式为。合成氨反应:N2(g)+
H2(g)
NH3(g)的△H=kJ/mol(用图中字母表示)。
【考点】
化学平衡的计算;