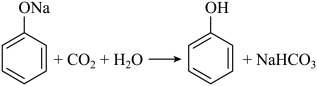
1.
Ⅰ.现有下列十种物质:①O2②铁③Na2O④CO2⑤稀H2SO4⑥Ba(OH)2⑦红褐色的氢氧化铁液体⑧氨水⑨盐酸⑩CaCO3
(1)按物质的树状分类法填写表格的空白处:
类别 | 金属单质 | 氧化物 | 溶液 | 电解质 | |
属于该类的物质 | ② | ③④ | ⑤⑧⑨ | ⑦ |
(2)写出一种实验室制备①的化学反应方程式:。
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为。
Ⅱ.已知硫酸在水中电离出H+、 , 某同学欲探究其某些化学性质,取3份溶液做了如下实验,请你用离子方程式解释实验现象:
(4)加铁粉有大量气体生产:
(5)加入Fe2O3后溶液变黄色:。
(6)滴加Ba(OH)2溶液产生白色沉淀。
【考点】
离子方程式的书写;