1.
 是制备半导体材料硅的重要原料,可由不同途径制备。
是制备半导体材料硅的重要原料,可由不同途径制备。
(1)
由 制备
制备 :
: (2)
在催化剂作用下由粗硅制备
(2)
在催化剂作用下由粗硅制备 :
: 。
。 ,
,  密闭容器中,经不同方式处理的粗硅和催化剂混合物与
密闭容器中,经不同方式处理的粗硅和催化剂混合物与 和
和 气体反应,
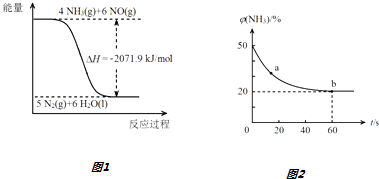
气体反应, 转化率随时间的变化如下图所示:
转化率随时间的变化如下图所示:
已知
时,由
制备
硅(填“吸”或“放”)热
。升高温度有利于制备硅的原因是。

① , 经方式处理后的反应速率最快;在此期间,经方式丙处理后的平均反应速率
。
②当反应达平衡时,的浓度为
, 平衡常数K的计算式为。
③增大容器体积,反应平衡向移动。
【考点】
吸热反应和放热反应;
化学平衡的计算;
制备实验方案的设计;
有关反应热的计算;
能力提升