1.
电化学原理在工农业生产中应用广泛,回答下列问题。
(1)
正丁烷[C4H10(g)]燃料电池工作原理如图甲所示。
(2)
电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图乙和图丙所示:
(3)
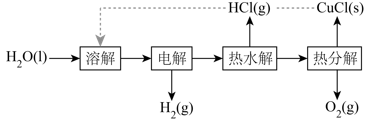
氯碱工业是高耗能产业,按下图将电解池与燃料电池相组合的新工艺可以节能30%以上,且相关物料的传输与转化关系如图所示(电极未标出)。

①写出B电极的电极反应式。
②标况下,当A极通入33.6L空气(O2的体积分数约为20%)时,可吸收丁烷的体积最多为L(结果保留两位小数)。

①图乙a电极上的电极反应式为。
②若图乙和图丙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%(),则两种装置中产生氨气的物质的量之比为。

①X的化学式为;Y在装置II中发生的电极反应为。
②图中氢氧化钠质量分数大小关系为a%b%。(选填“>”、“=”或“<”)
【考点】
电极反应和电池反应方程式;
电解池工作原理及应用;
能力提升
真题演练