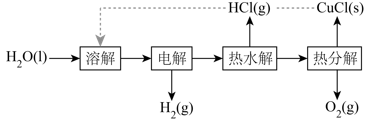
1.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献,回答下列问题:
(1)
向装有铁片的试管中加入稀 , 发生反应
, 发生反应 。观察到试管内有气泡产生,触摸试管外壁感觉发烫。
(2)
以镁片、铝片为电极,NaOH溶液为电解质溶液构成的原电池装置如图。
(3)
某种甲烷-氧气燃料电池装置如图,其中质子交换膜只允许
。观察到试管内有气泡产生,触摸试管外壁感觉发烫。
(2)
以镁片、铝片为电极,NaOH溶液为电解质溶液构成的原电池装置如图。
(3)
某种甲烷-氧气燃料电池装置如图,其中质子交换膜只允许 通过。
通过。
①该反应为(填“放热”或“吸热”)反应。
②该反应的反应物的总能量(填“>”或“<”)生成物的总能量。

①镁片是原电池的极,发生(填“氧化”或“还原”)反应。
②写出铝片上发生的电极反应:。
③将上述装置中的NaOH溶液换成稀硫酸,镁片处可观察到的现象为。

①电极c为电池的(填“正极”或“负极”)。
②气体a为(填“”或“
”)。
③若电路中转移2mol电子,则该燃料电池理论上消耗的在标准状况下的体积为L。
【考点】
电极反应和电池反应方程式;