1.
工业合成氨是人类科学技术的一项重大突破,其反应为
 .
.
回答下列问题:
(1)
①某条件下, 为
为 , 则
, 则
 ;
(2)
研究发现在铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注.
(3)
在合成氨工业中,原料气(
;
(2)
研究发现在铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注.
(3)
在合成氨工业中,原料气( 、
、 及少量CO、
及少量CO、 的混合气)在进入合成塔前需用铜氨液处理,目的是除去其中的CO,其反应为
的混合气)在进入合成塔前需用铜氨液处理,目的是除去其中的CO,其反应为
 . 铜氨液吸收CO的适宜生产条件是;
. 铜氨液吸收CO的适宜生产条件是; 中心原子的配位数是;
(4)
合成氨原料中的
中心原子的配位数是;
(4)
合成氨原料中的 可来源于水煤气,相关反应如下:
可来源于水煤气,相关反应如下:
②若键、
键的键能分别为
、
, 则断裂
键需要吸收的能量为kJ;
③下列关于合成氨工艺的理解正确的是(填选项字母);
A.合成氨的反应在较低温度下可自发进行
B.加入催化剂,有利于提高反应物的平衡转化率
C.将液化,不断将液氨移去,有利于反应正向进行
D.合成氨工业中采用循环操作,主要是为了增大化学反应速率

①该反应历程中最大活化能对应步骤的方程式为;
②该反应历程中、
需吸附在催化剂的表面活性位点进行反应生成
, 由合成氨反应的速率方程
(k为速率常数)可知,
越大,反应速率越小,分析其原因是;
a.
;
b.
.
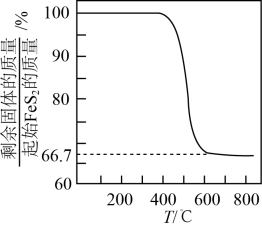
一定温度下,在2L的恒容密闭容器中加入与
发生反应a、b,
时两反应达到化学平衡状态,此时
的转化率是
, CO的物质的量是
. 计算反应b的平衡常数
(写出计算过程)。
【考点】
化学平衡常数;
能力提升
真题演练