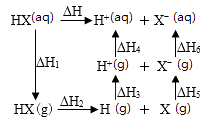1.
化学反应中的能量变化,通常表现为热量的变化,研究化学反应中的热量变化具有重要的意义。
(1)
下列变化属于吸热反应的是(填序号)。
(2)
已知:S(s)+O2(g,空气)=SO2(g) ΔH1 , S(S)+O2(g,氧气)=SO2(g) ΔH2 , 则ΔH1ΔH2(填“>”、“<”或“=”)。
(3)
在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
(4)
甲醇(CH3OH,
。两步反应的能量变化示意图如下:
(4)
甲醇(CH3OH, )既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
)既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
(5)
已知
(6)
热值指单位质量的燃料在氧气中完全燃烧生成稳定的氧化物时放出的热量,下表中热值最大的物质是。
①钢铁生锈 ②脂肪燃烧 ③液态水气化 ④灼热的木炭与CO2的反应
⑤Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 ⑥氢氧化钾和稀硝酸反应 ⑦硝酸铵溶解

①第一步反应是(填“放热”或“吸热”)反应;
②1mol(aq)全部氧化成
(aq)的热化学方程式是。
 )既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
)既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下表:
H-H | C-O | C≡O(CO的化学键) | H-O | C-H | |
化学键 | 436 | 343 | 1076 | 465 | 413 |
由此计算ΔH1=kJ/mol,已知ΔH3=+41kJ/mol,则ΔH2=kJ/mol。
①H2的燃烧热的ΔH1=-285.8kJ/mol;
②H2O(g)=H2O(l) ΔH2=-44kJ/mol;
③CH3OH(g)=CH3OH(l) ΔH3=-37.5kJ/mol;
请再结合上述(4)题中的部分数据写出CH3OH(l)燃烧热的热化学方程式。
可燃物 | H2(g) | CH4(g) | C2H5OH(l) | CO(g) |
燃烧热(kJ/mol) | -285.8 | -890.3 | -1366.8 | -283.0 |
【考点】
盖斯定律及其应用;
反应热的大小比较;
能力提升
真题演练