1.
实验室由安息香( ,
,  )在热
)在热 的氧化下制备二苯乙二酮(
的氧化下制备二苯乙二酮( ,
,  )
)
 ,
,  ,
, 相关信息列表如下:
物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
安息香 | 白色固体 | 133 | 344 | 难溶于冷水,溶于热水、乙醇、乙酸 |
二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水,溶于乙醇、苯、乙酸 |
冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |
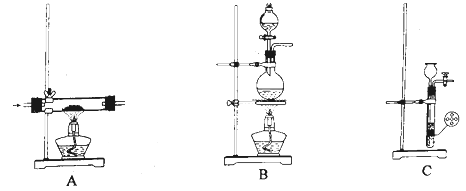
装置示意图如图所示:

实验步骤为:
①在圆底烧瓶中加入20mL冰乙酸、10mL水及 , 边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入4.2g安息香,加热回流1h。
③慢慢加入100mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶3.8g。
回答下列问题:
(1)
仪器B的名称是;冷却水应从(填“a”或“b”)口流出。
(2)
实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。
(3)
写出圆底烧瓶中发生的主要反应的化学方程式:。
(4)
本实验中,若采用催化剂量的 并通入空气进行实验,能否达到目的?(填“能”或“不能”),理由是。
(5)
本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是。
(6)
若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯
(7)
本实验的产率为(保留小数点后一位)。
并通入空气进行实验,能否达到目的?(填“能”或“不能”),理由是。
(5)
本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是。
(6)
若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯
(7)
本实验的产率为(保留小数点后一位)。
a.热水 b.乙酸 c.冷水 d.乙醇
【考点】
物质的分离与提纯;
制备实验方案的设计;
能力提升
真题演练