1.
酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)
下列物质中一定含有氧元素的是(填字母序号)。
(2)
某兴趣小组利用数字化实验装备,向盛有一定量氢氧化钠溶液的烧杯中,逐滴滴加稀盐酸,测得实验过程中溶液 的变化如图。
(3)
某粗盐中含有泥沙、
的变化如图。
(3)
某粗盐中含有泥沙、 和
和 等杂质,为除去该粗盐中的杂质,某化学兴趣小组的同学设计了如图所示的流程图。
(4)
向盛有
等杂质,为除去该粗盐中的杂质,某化学兴趣小组的同学设计了如图所示的流程图。
(4)
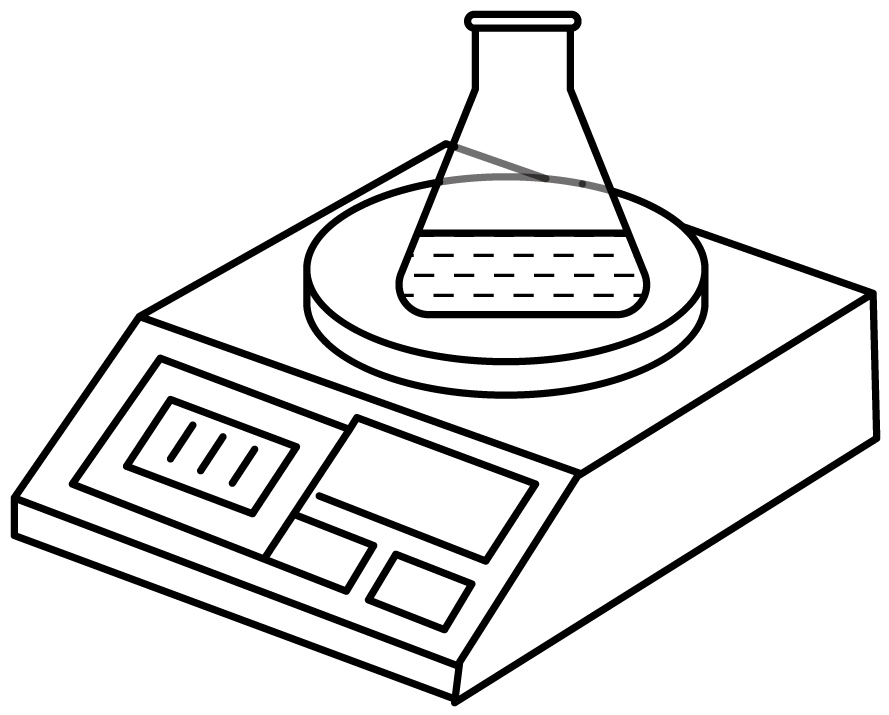
向盛有 石灰石样品的烧杯中加入
石灰石样品的烧杯中加入 稀盐酸,二者恰好完全反应,称得反应后烧杯内剩余物质的总质量为
稀盐酸,二者恰好完全反应,称得反应后烧杯内剩余物质的总质量为 , 则该石灰石样品中碳酸钙的质量分数是多少?
, 则该石灰石样品中碳酸钙的质量分数是多少?
a.酸 b.碱 c.盐 d.有机物

①写出该反应的化学方程式。
②A点溶液中的溶质为(用化学式表示)。
③为区分B点和C点所对应溶液,可选择的一种试剂为。

①溶解、过滤和蒸发时都需要用到的一种玻璃仪器是。
②试剂X的名称是。
③写出加入氢氧化钡溶液时发生反应的化学方程式(任写一个即可)。
【考点】
溶液的酸碱性与pH值的关系;
粗盐提纯;
盐的化学性质;
根据化学反应方程式的计算;
能力提升