1.
酸、碱、盐是初中化学学习的重要内容,在日常生活中应用非常广泛。
(1)
下列物质的俗名、化学式和种类均表示同一种物质的是
(2)
向实验室制取二氧化碳反应后的溶液中不断加入碳酸钠溶液,溶液的pH在此过程中的变化情况如下图所示:
(3)
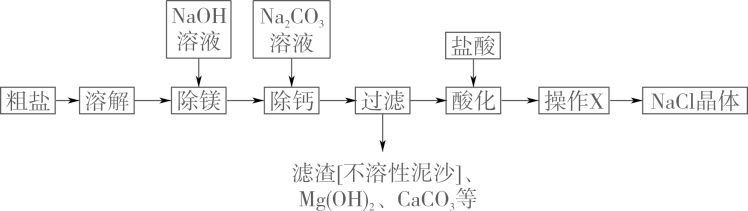
某粗盐水中,除氯化钠外还含有氯化钙、氯化镁、硫酸钠杂质,某化学小组设计以下流程提纯粗盐,所加试剂分别为氢氧化钠溶液、稀盐酸、碳酸钠溶液和氯化钡溶液(试剂均过量)。
(4)
向20g氯化钠和碳酸钠的固体混合物中加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量。
a.消石灰—CaO—氧化物 b.烧碱—NaOH—碱
c.纯碱—Na2CO3—碱 d.小苏打—NaHCO3—盐

①根据图像分析,原溶液中的溶质的化学式为。
②cd段发生反应的化学方程式;
③b点溶液中的溶质有什么?。
④碳酸钠溶液改为等浓度的碳酸钾溶液,加入到原溶液中当加入碳酸钾溶液的质量为mg时,所得溶液的pH7(填>”“<”或“=”)。

①写出步骤②中滴加试剂后发生反应的化学方程式:
②过滤后得到的澄清的溶液中除了氯化钠外,还混有哪些杂质,请设计实验加以证明,简要写出实验步骤、现象和结论。
【考点】
粗盐提纯;
常用盐的用途;
盐的化学性质;
能力提升
真题演练