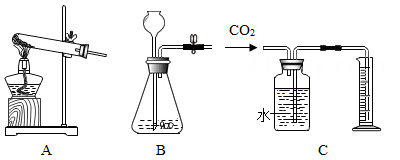
1.
小金同学想实验探究甲烷气体还原氧化铜的生成物情况。


资料:黄色粉末碳化铝(Al4C3)与盐酸或硫酸在常温下可发生剧烈反应成甲烷气体。
(1)
上图为小金设计的实验装置,如果用碳化铝与酸反应来制取甲烷气体,则以下气体发生装置中可以选用的是;
(2)
乙装置中的浓硫酸的作用是;
(3)
点燃丙中酒精灯之前要把甲乙丙装置中的空气排出,甲中产生气体后活塞K1、K2的关闭情况为____;
A.
K1、K2都关闭
B.
K1、K2都打开
C.
K1关闭,K2打开
D.
K1打开,K2关闭
(4)
把甲乙丙装置中的空气排出后,点燃丙中酒精灯,加热一段时间停止加热,继续通气,直到冷却。实验过程中记录的实验数据如下表:
装置 | 丙 | 丁 | 戊 | 己 |
实验前装置总质量/g | 210 | 397.8 | 371.5 | 365 |
实验后装置总质量/g | 207.2 | 399.6 | 372.6 | 365 |
若装置丙中的氧化铜只还原成铜,根据实验数据,请写出丙中反应的化学方程式。
【考点】
气体装置的装配、连接、选择与气密性检查;
能力提升
真题演练