1.
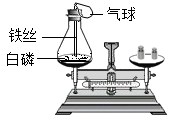
验证质量守恒定律
实验方案 | 方案一 | 方案二 |
实验装置 |
|
|
注意事项 | 有气体参加或气体生成的反应,必须在密闭系统中进行 | 无气体参加或气体生成的反应,可以在开放系统中进行 |
实验现象 | 白磷燃烧,产生大量白烟,放出热量,气球先膨胀后缩小 | 铁钉表面有一层红色物质析出,溶液由蓝色逐渐变为浅绿色 |
反应前总质量 | ||
反应后总质量 | ||
分析 | ||
结论 | 反应前后 | |
【考点】
质量守恒定律及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练