1.
为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)
20℃时,配制80g溶质质量分数为10%的NaOH溶液。
(2)
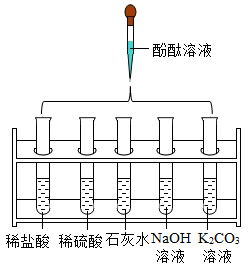
向1~5号小试管中分别滴加少量稀盐酸
(3)
借助传感器对稀NaOH溶液与稀盐酸的中和反应进行研究,实验装置如图,三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液。

①用图中仪器完成实验,还缺少的玻璃仪器是(填名称);玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)

①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。



①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是,实验进行到60s时溶液中的溶质为(填化学式)。
②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
【考点】
酸碱指示剂的性质及应用;
物质发生化学变化时的能量变化;
化学方程式的书写与配平;
一定溶质质量分数的溶液的配制;
物质的鉴别、推断;
实验数据处理或者误差分析的探究;
能力提升