1.
如图是用浓硝酸、铜片、水等试剂,探究浓、稀硝酸强氧化性并观察还原产物的实验装置。
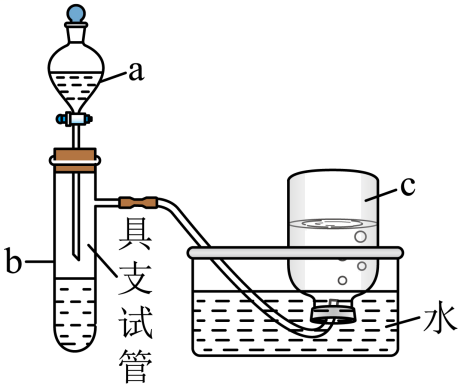
(1)
I.浓硝酸的强氧化性实验
(2)
实验中观察到能证明浓硝酸具有强氧化性的现象是。
(3)
Ⅱ.稀硝酸的强氧化性实验
(4)
能证明稀硝酸与铜反应产生NO的实验现象是____(填标号)。
A.
c中收集到无色气体
B.
c中收集到的无色气体接触空气后变为红棕色
C.
b中产生的无色气体接触空气后变为红棕色
(5)
Ⅲ.问题讨论
将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中放入约2mL浓硝酸,集气瓶c中收集到一种无色气体。
仪器a的名称为。上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,可以将浓硝酸稀释后加入具支试管再与铜片反应,此时发生反应的离子方程式是;集气瓶c中仍收集到一种无色气体,此时向集气瓶c中通入一定量的氧气后集气瓶c中逐渐充满无色溶液,请写出通入一定量的氧气后集气瓶c中发生的总反应方程式。
用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因,是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
你认为上述看法(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:。
【考点】
氧化还原反应;
硝酸的化学性质;
性质实验方案的设计;
能力提升

