1.
海水中化学元素的利用是海水综合利用的重要方面,从海水中提取的粗盐、镁、溴(Br2)等产品是多种工业的基础原料。
(1)
Ⅰ.海水提取的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作,进行提纯:①加入Na2CO3溶液;②加入NaOH溶液;③加入BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;⑥溶解。正确的操作顺序是(填标号)。
(2)
加入Na2CO3溶液时发生反应的离子方程式为。
(3)
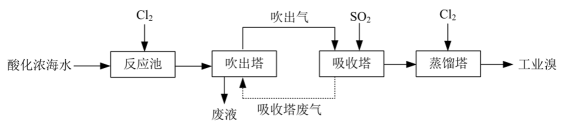
Ⅱ.苦卤(海水晒盐后得到的母液)中含有NaBr等物质。从苦卤中提Br2的流程如下:
(4)
“吸收”过程的离子方程式为。
(5)
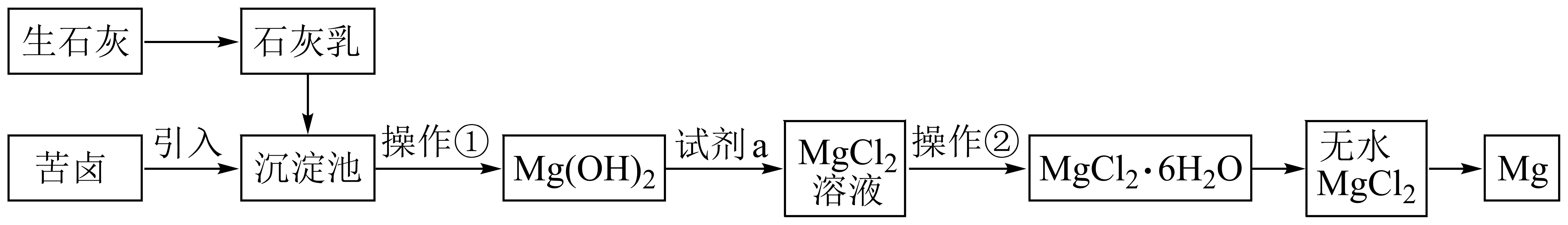
Ⅲ.海水提镁的工艺流程如下:
(6)
工业上采用电解熔融MgCl2而不是熔融MgO来制取镁单质,原因是。
(7)
高温下用镁还原四氯化钛(TiCl4)是制取金属钛的重要方法,该反应的化学方程式为。下列气体可以作为该反应保护气的是(填标号)。
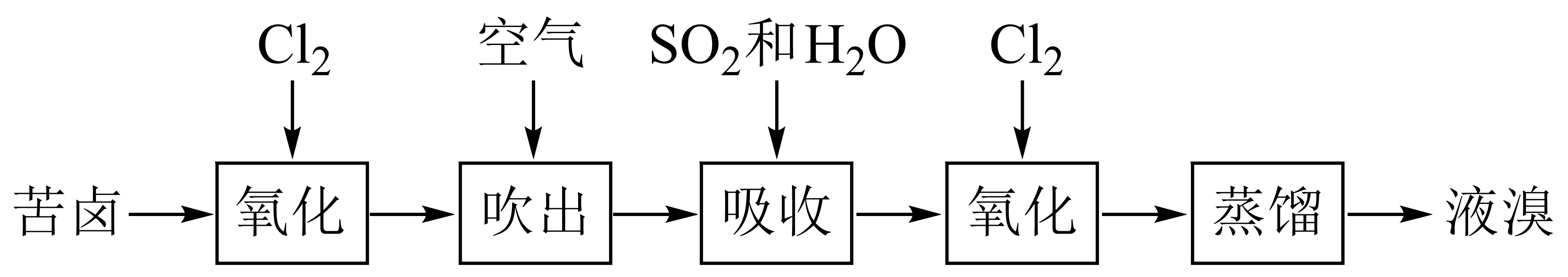
以苦卤为原料提Br2而不是直接利用海水提Br2 , 优势在于。
已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
沉淀池中发生主要反应的离子方程式为。
a.N2 b.Ar c.CO2 d.O2
【考点】
海水资源及其综合利用;
氯、溴、碘及其化合物的综合应用;
粗盐提纯;
能力提升