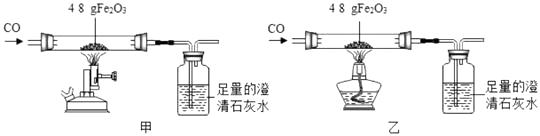
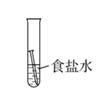
1.
“自热火锅”给我们的生活带来一定的便利。小明同学就某种自热火锅的“自热”原理产生了兴趣,查阅到的相关资料如下:

①自热火锅食用方法:下层底盒中倒入适量冷水,打开加热包塑料膜,将加热包放入凉水中:放上上层食材盒,倒入一定食用冷水,盖上盖子,15分钟后,即可开盖食用。(图乙为自热火锅结构示意图)
②加热包内含有铁粉、铝粉、焦炭粉、生石灰等物质,其中的金属粉末与碳粉在热水中发生化学反应,可短时间放出大量的热,后续缓慢放热。
③自热火锅工作时,下层加热盒中空气温度随时间变化的图像如图丙所示。
为解释自热火锅的工作原理,请结合上述材料,对oa、ab、bc各段的温度变化做出解释。
【考点】
金属的腐蚀与防护;
能力提升
变式训练
拓展培优
真题演练