1.
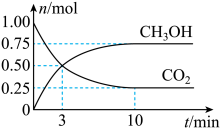
为倡导“节能减排”和“低碳经济”,降低大气中CO2含量及有效地开发利用CO2 , 工业上可用CO2来生产燃料甲醇。在体积为2L的密闭容器中,充入1molCO2、3molH2 , 一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH的物质的量随时间变化如图所示。
(1)
写出该反应的化学平衡常数表达式:K=。
(2)
在3min末,反应速率v(正)v(逆)(选填>、<或=)。
(3)
从反应开始到平衡,平均反应速率v(CO2)=。达到平衡时,H2的转化率为。
(4)
下列措施可以加快反应速率的是____。
A.
升高温度
B.
加入催化剂
C.
增大压强
D.
及时分离出CH3OH
(5)
若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(H2)=0.45mol•L-1•s-1;乙:v(CO2)=0.2mol•L-1•s-1;丙:v(CH3OH)=6mol•L-1•min-1 , 则甲、乙、丙三个容器中反应速率由快到慢的顺序为。
【考点】
化学平衡常数;
化学反应速率的影响因素;
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
化学平衡的计算;
化学反应速率和化学计量数的关系;
能力提升





