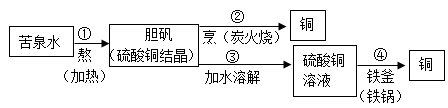
1.
复分解反应
⑴定义:在溶液中,两种化合物相互交换成分,生成另外两种化合物的反应。
⑵特点:仅相互交换成分,元素化合价变化。
⑶实质:之间相互结合,生成沉淀、气体或水的过程。
⑷发生的条件
反应类型 | 反应物条件 | 生成物条件 |
酸+金属氧化物→盐+水 | 酸可溶 | 应具备下列条件之一: ①有沉淀生成; ②有气体放出; ③有水生成 |
碱+盐→新碱+新盐 | 二者都可溶 | |
盐1十盐2→新盐1+新盐2 | 二者都可溶 | |
酸+盐→新酸+新盐 | 盐可溶或难溶,酸可溶 | |
酸+碱→盐+水 | 酸可溶 |
【考点】
复分解反应及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练