1.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。298.15K 时,N2、H2与 NH3 的平均能量与合成氨反应的活化能的曲线图如下所示,据图回答问题:
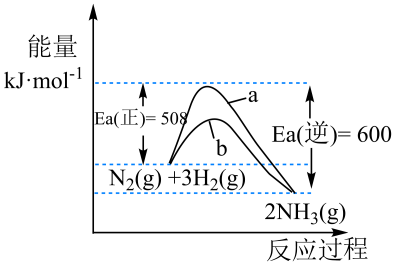
(1)
若反应中生成 2 mol 氨气,则反应 (填“吸热”或 “放热”) kJ
(2)
图中曲线(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理: ;
(3)
目前合成氨工业广泛采用的反应条件是 500℃、20~50MPa、铁触媒作催化剂,反应转化率不超过 50%。工业上为了进一步提高氨气的产率,你认为下列措施经济可行的是:____ ;
A.
升高反应温度,让更多的分子变成活化分子
B.
降低反应温度,让反应向着有利于氨气生成的方向进行
C.
将液氨及时从反应体系中分离出来
D.
寻求能在更低的温度下有很强催化活性的新型催化剂
(4)
合成氨所需的氢气可由甲烷与水反应制得,发生反应 ;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
;在一定温度下,在体积为 1L 的容器中发生上述反应,各物质的物质的量浓度变化如下
t/min | CH4(mol/L) | H2O(mol/L) | CO(mol/L) | H2(mol/L) |
0 | 0.2 | 0.3 | 0 | 0 |
2 | n1 | n2 | n3 | 0.3 |
3 | n1 | n2 | n3 | 0.3 |
4 | 0.09 | 0.19 | x | 0.33 |
①表中 x= mol/L;前 2min 内 CH4 的平均反应速率为
②下列不能作为反应达到平衡的判据是。
A.气体的压强不变 B.v 正(CH4)=v 逆(CO) C.K 不变
D.容器内气体的密度不变 E.断开 1molH-O 键同时断开 3molH-H 键
【考点】
吸热反应和放热反应;
催化剂;
化学平衡移动原理;
化学平衡状态的判断;
化学反应速率与化学平衡的综合应用;