1.
某科技小组对PCl3与Cl2间的反应进行了探究,将2 mol PCl3、2 mol Cl2分别置于多个容积为2 L的密闭容器中,然后在不同温度和压强下反应生成PCl5 , 反应一段时间后,测得Cl2的转化率如图1所示:


(1)
某容器内反应到A点所用时间为30 min,则此段时间内v(PCl3)=。计算A点时该反应的平衡常数K=;
(2)
P1P2(用“>”、“<”、“=”表示,后同),假设A、B、C点对应于该反平衡状态,则对应的平衡常数KA , KB和KC相对大小关系为。
(3)
写出一种能提高PCl3转化率的方法。
(4)
请在图2绘制体系中绘制PCl5的百分量随反应温度(T)变化的图象(画出大概趋势即可)
【考点】
化学反应速率;
化学平衡常数;
化学平衡移动原理;
能力提升
真题演练







 B.
B. 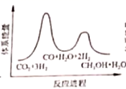 C.
C. 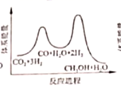 D.
D. 
