1.
处理、回收CO是环境科学家研究的热点课题。
(1)
环境空气质量指数(AQI)日报和实时报告包括了NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(2)
CO用于处理大气污染物N2O所发生的反应为N2O(g)+CO(g) CO2(g)+N2(g) ΔH=-365 kJ·mol-1 , 几种物质的相对能量如下:
CO2(g)+N2(g) ΔH=-365 kJ·mol-1 , 几种物质的相对能量如下:
(3)
在实验室,采用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5 (s)+5CO(g) 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
(4)
工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2 , 在250 ℃发生反应:CO(g)+2H2(g)
5CO2(g)+I2(s)。测得CO的转化率如图1所示。
(4)
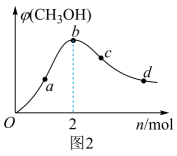
工业上,利用CO和H2合成CH3OH,在1 L恒容密闭容器中充入1 mol CO(g)和n mol H2 , 在250 ℃发生反应:CO(g)+2H2(g) CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是。
CH3OH(g),测得平衡时混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是。
已知:①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K= , 写出此反应的热化学方程式:。
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/kJ·mol-1 | 475.5 | 283 | a | 393.5 |
①a=kJ·mol-1 , 改变下列“量”,一定会引起ΔH发生变化的是(填代号)
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
②有人提出上述反应可以用“Fe+”作催化剂。其总反应分两步进行:
第一步:;(写化学方程式)
第二步:FeO++CO=Fe++CO2。
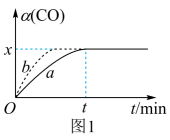
①相对曲线a,曲线b仅改变一个条件,改变的条件可能是加入催化剂或者。
②在此温度下,该可逆反应的平衡常数K=(用含x的代数式表示)。
【考点】
热化学方程式;
化学平衡常数;
化学反应速率的影响因素;
化学平衡移动原理;
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
能力提升




