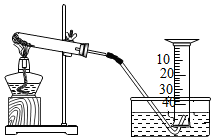
1.
科学探究是新课标要求的重要能力,某兴趣小组进行过氧化氢制氧气的探究实验,不小心把过氧化氢溶液飞溅到了表面变黑的铜管上,发现立即产生大量气泡,查阅资料:该铜管表面黑色固体是氧化铜(CuO) 。

[提出问题]氧化铜是否可以作为过氧化氢分解的催化剂?
[进行假设]氧化铜可以作为过氧化氢分解的催化剂。
(1)
[实验验证]取1g纯净的氧化铜粉末,两支装有5mL3%过氧化氢溶液的试管,进行以下实验:
(2)
[得出结论],写出该反应的文字或符号表达式
(3)
[反思]该实验(填”能”或”不能”)证明氧化铜是过氧化氢分解的催化剂,若不能,还应该补充的实验探究步骤是:
实验步骤 | 实验现象 | |
实验一 | 将带火星的木条伸入装有5mL3%的过氧化氢溶液的试管中 | 木条 |
实验二 | 向另一支装有5mL3%的过氧化氢溶液的试管中加入,再将带火星的木条伸入试管中 | 木条复燃 |
①将实验二试管中的混合物过滤出黑色固体,洗涤,干燥,。
②用实验证明黑色固体的(填”性质”、”物理性质”或”化学性质”)没变。
【考点】
催化剂的特点与催化作用;
实验探究物质的性质或变化规律;
能力提升
真题演练