1.
以废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程可表示为:

(1)
Mn2+的基态核外电子排布式为。
(2)
“酸浸”时为提高锰离子的浸出率,可采取的措施有。
(3)
“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+ , 滤渣1的主要成分为FeS2和S,写出该反应的离子方程式。
(4)
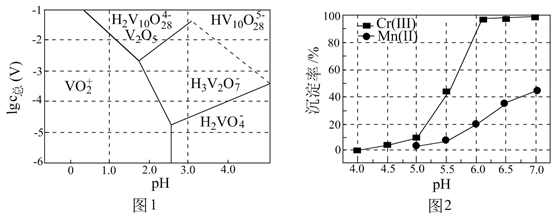
已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为;滤渣2除MnO2、CaCO3外主要成分是(填化学式)。
(5)
测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)。
[已知:+
→CO2↑+Mn2+(未配平)]
【考点】
物质的分离与提纯;
能力提升
真题演练